1.- INTRODUCCIÓN
En esta práctica se pretende obtener experimentalmente la
constante de equilibrio químico de una disolución, más concretamente las de un
indicador.
Los indicadores son disoluciones de ácidos débiles. Para
hallar la concentración de las diferentes especies, emplearemos la
espectrofotometría.
Los resultados de este experimento serán comunicados
oralmente al resto de la clase.
2.- MATERIALES
Los materiales que hemos utilizado en ambas sesiones han
sido:
ᴕ
- Bureta
- Pipetas
- Probeta
- pH-metro
- Cubetas
- Espectrofotómetro
- Viales
- Baños termostatizados
- Calorímetro
3.- FUNDAMENTO TEÓRICO
La constante de
equilibrio para una cierta reacción química nos da la relación que hay entre
las actividades químicas de las especies que se encuentran en el equilibrio.
Así para una reacción genérica tenemos que:
Las actividades de
las diferentes especies químicas pueden relacionarse con la concentración por
medio de los coeficientes de actividad γ. Estas relaciones
solamente serán válidas para unas condiciones de presión y temperatura dadas,
ya que estas variables desempeñan un papel fundamental en las reacciones.
En nuestro caso
emplearemos la fenolftaleína (C20H14O4) un ácido orgánico débil muy empleado
como indicador del viraje del pH, ya que presenta un fuerte cambio de color.
Así nos encontramos con:
Podemos considerar que γ=1 ya que la pendiente
que tienen en la Ley de Beer es muy elevada.
De esta manera, podemos tomar logaritmos
decimales y escribir la siguiente relación:
El indicador tiene dos formas, una ácida, en
la que se presenta incoloro, y otra básica, de tonos rosados. Cada una de ellas
tiene una longitud de onda λ diferente. En nuestras condiciones del laboratorio,
mantenemos la longitud de la cubeta constante y también la concentración molar
del indicador, podemos hallar la siguiente relación con las absorbancias A de
las diferentes especies:
Para medir la absorbancia, necesitamos emplear
el espectrofotómetro, ya que medirá el valor de la A sin alterar el equilibrio,
ya que se trata de un método físico.
Cuando en una disolución hay más de una
especie, el espectrofotómetro detecta la suma de absorbancias de todas las
especies, ya que no puede distinguir qué fracción de absorbancia corresponde a
cada molécula. Sin embargo, si las distintas especies tienen absorbancias
diferentes a diferentes longitudes de onda, y conocemos el espectro de los
componentes por separado, podemos descomponer matemáticamente el espectro de la
mezcla en los espectros de sus componentes.
La clave que nos permite analizar mezclas es
que la longitud de onda es una propiedad aditiva, es decir, que a cada longitud
de onda la absorbancia de una disolución es la suma de las absorbancias de
cada una de las especies.
donde ε es la absorbancia molar de cada
especie a la longitud de onda deseada, y b la longitud del paso de la celda.
En el caso de una mezcla de dos compuestos X e
Y, se pueden distinguir dos casos. En la figura se observa que las bandas de
absorción de los compuestos puros X e Y se solapan en el intervalo de
longitudes de onda considerado. El mejor modo de tratar este caso es mediante
un procedimiento gráfico, haciendo medidas a muchas longitudes de onda. En la
figura siguiente las bandas de X e Y sólo se solapan un poco en algunas
regiones. Este caso se resuelve escogiendo la longitud de onda X donde X es el
que más contribuye a la absorbancia, y la longitud de onda λ a la que Y es el
mayor contribuyente.
En la segunda sesión se medirán los valores de
la constante de equilibrio en diferentes condiciones a las ambientales. De esta
manera, conocemos cómo se altera K en diferentes temperaturas.
4.- PROCEDIMIENTO EXPERIMENTAL
En esta práctica, se
van a registrar los espectros de absorción de 7 disoluciones de fenolftaleína
para poder hallar el pKa de ésta.
Teniendo como datos de la bibliografía, con los que
compararemos nuestros datos obtenidos, que el intervalo de viraje de la
fenolftaleína es de 8,2-9,8 y que cambia de incoloro a púrpura con un pKa=9,6.
Para calcular el
volumen total de las disoluciones preparadas, se ha tenido en cuenta que dos
grupos más realizan la experiencia con
el mismo indicador, por tanto, se ha hecho una estimación de la cantidad de
reactivos utilizados.
1.-
El primer paso que hemos llevado a cabo consiste en preparar una
disolución de pH ácido en la cual estaría únicamente la forma del indicador
HIn. En un matraz de 250mL preparamos una disolución 0.1M de HCl.
2.-
A continuación preparamos una disolución en la que el indicador se
presenta en su forma básica, es decir, una disolución de NaOH 0.1M. Preparamos
dicha disolución en un matraz de 500mL. Se prepara el doble de volumen porque
esta disolución también se va a utilizar para preparar las disoluciones tampón
de ácido bórico.
3.-
Las 5 disoluciones restantes se corresponden a 5 disoluciones tampón de
ácido bórico de pH comprendido en el del viraje del indicador (en nuestro caso
fenolftaleína). Para ello:
Se realiza una valoración de la disolución de bórico con NaOH usando
como indicador la fenolftaleína. Según vamos valorando, se va reduciendo la
concentración de la especie ácida y va aumentando la concentración de la
especie básica. De esta manera, el pH en función del volumen de valoración es:
|
pH
|
% valor
|
|
8
|
5,48887013
|
|
8,1
|
6,81324767
|
|
8,2
|
8,42867838
|
|
8,3
|
10,3844473
|
|
8,4
|
12,7309356
|
|
8,5
|
15,5158399
|
|
8,6
|
18,778855
|
|
8,7
|
22,5449686
|
|
8,9
|
31,5686051
|
|
9
|
36,7394667
|
|
9,1
|
42,2345663
|
|
9,2
|
47,9288592
|
|
9,3
|
53,6774834
|
|
9,4
|
59,3299902
|
|
9,5
|
64,7457612
|
|
9,6
|
69,8073539
|
|
9,7
|
74,4292423
|
|
9,8
|
78,5609039
|
Como las 5 disoluciones deben tener un pH comprendido en el intervalo de
viraje de la fenolftaleína, tendremos en cuenta los datos que se corresponden
con el 30%, 40%, 50%, 60% y 70% del volumen de la valoración.
|
pH
|
8,87
|
9,06
|
9,24
|
9,41
|
9,60
|
|
%
|
30
|
40
|
50
|
60
|
70
|
4.- Para llevar a cabo esta experiencia
nos queda por realizar la disolución de fenolftaleína. Para ello tomamos una
cierta cantidad de fenolftaleína y disolvemos en una mezcla de etanol y agua al
70 y 30%, respectivamente. De manera que la concentración inicial de
fenolftaleína sea del 0,06%.
5.- El siguiente paso antes de registrar
los espectros de absorción es medir (directamente con el pH-metro) y anotar el
pH de cada una de las disoluciones preparadas anteriormente de manera que
posteriormente podamos calcular el pKa.
6.- Finalmente, se registran los
espectros de absorción en el espectrofotómetro de cada una de las disoluciones.
Para ello en un matraz aforado de 25 ml añadimos 1 ml de fenolftaleína 0.06% y enrasamos con las disoluciones de NaOH y HCl
que se han preparado anteriormente, para las formas básica y ácida,
respectivamente. La absorbancia de la
disolución de HCl es 0, ya que la fenolftaleína es incolora en su forma ácida.
Para medir la absorbancia de las disoluciones tampón, como en
el caso anterior, en un matraz de 25 mL añadimos 1 mL de fenolftaleína y enrasamos
con cada una de las 5 disoluciones tampón preparadas.
7. - Con los datos obtenidos en el
espectrofotómetro, de parejas de absorbancias y longitudes de ondas, podemos
realizar una gráfica con la que obtendremos el valor del pKa. Para ello,
tomamos la absorbancia máxima básica (AHA), ya que ante la forma
ácida es incolora, y su correspondiente longitud de onda. Para esta longitud de
onda tomamos los valores de las absorbancias de las cinco disoluciones tampón
(A) y de la disolución ácida (AA-) de manera que podamos construir
una gráfica pH frente a log A HA - A A - A A -
. El valor del pKa vendrá determinado por el
valor de la recta en el que el pH=0.
En la segunda parte de la sesión, la experiencia de
laboratorio propiamente dicha fue muy rápida y corta ya que luego había que
exponer los pósters que habíamos preparado de la sesión anterior.
Experimentalmente trabajamos con las disoluciones del día
anterior, salvo la disolución más básica que tuvimos que repetirla porque se
había decolorado. Esto es así porque en los extremos de pH, la fenolftaleína se
degrada.
Cada grupo de cada indicador calentó sus disoluciones a una
temperatura distinta de manera que podamos estudiar cómo cambia el pKa a diferentes
temperaturas y medimos los espectros correspondientes a cada una.
Al final de la sesión presentamos los pósters de la práctica
anterior que cada grupo defendía. Fue una práctica interesante ya que pudimos
conocer el resultado del resto de indicadores con los que no habíamos
trabajado.
5.- PRESENTACIÓN DE RESULTADOS
Los resultados obtenidos durante esta práctica son los que a
continuación se presentan.
Antes de empezar con ningún cálculo, preparamos las
disoluciones como ya hemos comentado antes. Para ello hacemos los cálculos
oportunos de manera que obtengamos disoluciones con la concentración exacta que
hemos marcado y el volumen necesario. Para preparar la disolución de 250mL de
fenolftaleína 0,06% y saber cuántos gramos de ésta tenemos que coger hacemos el
siguiente cálculo:
250 · 0’0006 = 0’15 gramos
Experimentalmente tomamos 0.156 gramos, los cuáles disolvimos
en una mezcla de etanol y agua para lo que tomamos 75mL de etanol y 175mL de
agua.
Para preparar las disoluciones tampón, no realizamos la
valoración ya que no necesitamos conocer la concentración de ácido bórico sino
que tomamos 15mL de ácido bórico y vamos añadiendo NaOH hasta obtener un pH
próximo a los valores que hemos marcado antes del 30, 40, 50, 60 y 70% y
posteriormente le añadimos 1 mL de fenolftaleína.
Dichas disoluciones presentan un pH (antes de añadir la
fenolftaleína) de:
|
Disolución
tampón
|
1
|
2
|
3
|
4
|
5
|
|
pH
|
8,87
|
9,07
|
9,23
|
9,41
|
9,65
|
Una vez que ya tenemos preparadas todas las disoluciones y
antes de registrar los espectros, medimos el pH de cada disolución una vez que
ya le hemos añadido 1mL de fenolftaleína.
Una vez que ya tenemos estos datos, podemos obtener
directamente los espectros de cada una de las disoluciones. En la siguiente
gráfica se recogen los datos de los 7 espectros juntos para poder ver las
diferencias entre unas disoluciones y otras.
|
|
12.41
|
|
9.16
|
|
|
9.64
|
|
8.91
|
|
|
9.49
|
|
1.06
|
|
|
9.3
|
|
|
De estos espectros tomamos los datos necesarios para calcular
la constante de equilibrio: AA- (max)=1,4064 cuya λ correspondiente
es 552 nm. A esta longitud de onda tomamos las absorbancias del resto de
disoluciones:
|
Disoluciones
|
Acida
|
1
|
2
|
3
|
4
|
5
|
Básica
|
|
A
(λ=552nm)
|
-0,0046
|
0,1821
|
0,3335
|
0,4988
|
0,7474
|
1,0160
|
1,4064
|
Representamos pH-log(AHA—A/(A-AA-)) y
para el valor de pH=0 obtenemos el valor del pKa:
Por lo que podemos concluir que el pKa obtenido tiene un
valor: pKa=9.4295.
Comparando este valor con el teórico (pKa=9,6) obtenemos un
error del 1,78%, el cuál es bastante aceptable teniendo en cuenta que a lo
mejor al temperatura es distinta con respecto al valor tabulado.
En la segunda parte de la práctica, utilizamos las mismas
disoluciones que en la sesión anterior, salvo la disolución mas básica que se
decoloró, calentamos a la temperatura establecida, tomamos medidas del pH y
registramos los espectros.
Nos dividimos las diferentes temperaturas entre los grupos
del mismo indicador de manera que nosotros estudiamos como varía si aumentamos
la temperatura hasta 30°C, aunque presentaremos los datos de las demás
temperaturas: 35 y 40°C.
Medidas del pH cuando la temperatura es de 30°C:
|
Disoluciones
|
Acida
|
1
|
2
|
3
|
4
|
5
|
Básica
|
|
pH (30°C)
|
0,89
|
8,35
|
8,94
|
9,07
|
9,22
|
9,18
|
11,8
|
Cuando calentamos las muestras a 30° obtenemos los siguientes
espectros de absorción en función del pH:
|
|
11,8
|
|
8,94
|
|
|
9,18
|
|
8,35
|
|
|
9,22
|
|
0,89
|
|
|
9,07
|
|
|
De estos
espectros tomamos los datos necesarios para calcular la constante de
equilibrio: AA- (max)=1,6927 cuya λ correspondiente es 551,5 nm. A
esta longitud de onda tomamos las absorbancias del resto de disoluciones:
|
Disoluciones
|
Acida
|
1
|
2
|
3
|
4
|
5
|
Básica
|
|
A
(λ=551.5
nm)
|
-0,0074
|
0,1316
|
0,3235
|
0,4901
|
0,7262
|
0,9857
|
1,6927
|
Representamos
pH-log(AHA—A/(A-AA-)) y para el valor de pH=0 obtenemos
el valor del pKa:
Por lo que podemos concluir que el pKa obtenido tiene un
valor: pKa=9,2362.
Si
calentamos las disoluciones otros 5°C más obtenemos los siguientes espectros:
|
10.65
|
|
8.46
|
|
|
|
8.87
|
|
8.33
|
|
|
8.75
|
|
1.65
|
|
|
8.68
|
|
|
De estos
espectros tomamos los datos necesarios para calcular la constante de
equilibrio:
AA- (max)=1.2129
cuya λ correspondiente es 552.5 nm. A esta longitud de onda tomamos las
absorbancias del resto de disoluciones:
|
Disoluciones
|
Acida
|
1
|
2
|
3
|
4
|
5
|
Básica
|
|
A
(λ=551.5 nm)
|
-0,0135
|
0,2485
|
0,4067
|
0,7603
|
0,9585
|
1,2153
|
1,2129
|
Representamos
pH-log(AHA—A/(A-AA-)) y para el valor de pH=0 obtenemos el valor del
pKa:
Por lo que podemos concluir que el pKa obtenido tiene un
valor: pKa=8.5582.
Para realizar esta recta de
calibración hemos tenido que desechar un dato, ya que obteníamos una lectura de
absorbancia más elevada que la realizada a pH básico, y no podemos llevar a
cabo el logaritmo por tratarse de un número negativo. Por ello, llevamos a cabo
la interpolación a los cuatro datos restantes, por lo que la recta de
interpolación se ajusta más a los datos que tenemos, ya que son menos.
Cuando calentamos a
40°C obtenemos que:
|
|
11.8
|
|
9.3
|
|
|
9.7
|
|
9.3
|
|
|
9.5
|
|
1.1
|
|
|
9.6
|
|
|
De estos
espectros tomamos los datos necesarios para calcular la constante de
equilibrio:
AA- (max)= 1,1704 cuya λ
correspondiente es 553 nm. A esta longitud de onda tomamos las absorbancias del
resto de disoluciones:
|
Disoluciones
|
Acida
|
1
|
2
|
3
|
4
|
5
|
Básica
|
|
A
(λ=551.5 nm)
|
-0,0165
|
0,152
|
0,1288
|
0,4498
|
0,5532
|
0,8694
|
1,1704
|
Representamos pH-log(AHA—A/(A-AA-)) y
para el valor de pH=0 obtenemos el valor del pKa:
Por lo que podemos concluir que el pKa obtenido tiene un
valor: pKa=9.566.
6.- CONCLUSIONES
Observando los datos
obtenidos en el laboratorio, podemos concluir que:
- El valor del pKa obtenido es muy parecido al pKa tomado de la bibliografía como dato teórico, por lo que el error es muy pequeño, lo que hace que el método y los resultados experimentales sean fiables.
- Sólo trabajamos los resultados de este colorante con un proceso porque no presenta punto isosbéstico ya que ante disoluciones ácidas no presenta coloración.
- En cuanto a la reacción que se produce, podemos señalar que dado que los valores de pH que obtenemos según se va aumentando la temperatura para las distintas disoluciones son menores, quiere decir que la concentración de [H+] aumenta con la temperatura, es decir, la reacción se ve favorecida a altas temperaturas con lo que según el principio de Le Chatelier, la reacción es endotérmica.
- Los valores de absorbancia van aumentando, según aumentan los valores del pH en cada serie dado que la fenolftaleína presenta mayor coloración cuanto más básica sea la disolución, aunque como se ha mencionado anteriormente en valores muy básicos de pH se vuelve a hacer incolora.
7.- BIBLIOGRAFÍA
z


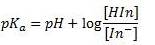













Gracias Daniel, lo pondre en practica en mi curso
ResponderEliminar