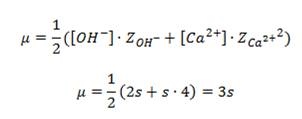En esta práctica de laboratorio
se han preparado diferentes disoluciones de CaOH en diferentes medios para
comprobar cómo se comporta en las diferentes situaciones. Para ello,
introducimos en ellos aproximadamente 0.2 g de óxido de calcio, ya que al ser mezclado
con agua, se formara el hidróxido que buscamos.
En cada vial introduciremos una
disolución diferente, en unos casos agua, en otros NaCl con diferente
concentración, NaOH y CaCl2. Esto lo hacemos así para comprobar cómo
se comporta el hidróxido de calcio en disoluciones que presentan sus mismos
iones, lo cual nos permitirá estudiar el efecto ión común. Esto es lo que
introdujimos en cada vial:
|
VIAL
|
DISOLUCION
|
MASA CaO2 (g)
|
|
1
|
Agua Destilada
|
0.2
|
|
2
|
NaCl 0.05 M
|
0.209
|
|
3
|
NaCl 0.1 M
|
0.198
|
|
4
|
NaCl 0.2 M
|
0.202
|
|
5
|
NaCl 0.4 M
|
0.207
|
|
6
|
NaCl 0.6 M
|
0.208
|
|
7
|
NaOH 0.1 M
|
0.202
|
|
8
|
CaCl2 0.1 M
|
0.204
|
Se dejan reposar las disoluciones
durante un tiempo prudente y se filtran. Valoramos la disolución obtenida para
medir la concentración de iones en disolución.
Para determinar la concentración
de OH-, valoramos la disolución con HCl, cuya concentración es
conocida (0.02 M) usando fenolftaleína como indicador, ya que cuando
desaparezca su característico color rosa fucsia sabremos que la valoración
ácido-base ya ha sido completada.
Para conocer la concentración de
Ca2+ en disolución, llevamos a cabo una valoración complexométrica
con AEDT 0.01 M, siendo el NET el indicador. Sabremos que el cambio de pH se ha
producido cuando la disolución pasa de un color pardo rojizo a azul intenso.
Los resultados obtenidos en el
laboratorio han sido:
|
VIAL
|
V1 HCl
(mL)
|
V2 HCl
(mL)
|
V HCl
(mL)
|
V1 AEDT
(mL)
|
V2 AEDT
(mL)
|
V AEDT
(mL)
|
|
Agua Destilada
|
9.1
|
9.2
|
9.15
|
12.5
|
12.6
|
12.55
|
|
NaCl 0.05 M
|
10.2
|
10.4
|
10.3
|
13.2
|
13.0
|
13.1
|
|
NaCl 0.1 M
|
10.2
|
10.6
|
10.4
|
13.8
|
14.0
|
13.9
|
|
NaCl 0.2 M
|
11.2
|
11.7
|
11.45
|
14.5
|
14.3
|
14.4
|
|
NaCl 0.4 M
|
12.1
|
12
|
12.05
|
15.7
|
15.7
|
15.7
|
|
NaCl 0.6 M
|
12.6
|
12.6
|
12.5
|
16.1
|
15.9
|
16.0
|
|
NaOH 0.1 M
|
|
|
|
5.5
|
4.5
|
5.0
|
|
CaCl2 0.1
M
|
7.5
|
7.7
|
7.6
|
|
|
|
A partir de estos datos, podemos
calcular la concentración de OH- sabiendo que el punto de equilibrio
se cumple que:
De donde obtenemos que:
|
VIAL
|
V HCl
(mL)
|
[OH-]
(M)
|
|
Agua Destilada
|
9.15
|
0.0366
|
|
NaCl 0.05 M
|
10.3
|
0.0412
|
|
NaCl 0.1 M
|
10.4
|
0.0416
|
|
NaCl 0.2 M
|
11.45
|
0.0458
|
|
NaCl 0.4 M
|
12.05
|
0.0482
|
|
NaCl 0.6 M
|
12.5
|
0.05
|
|
NaOH 0.1 M
|
|
|
|
CaCl2 0.1
M
|
7.6
|
0.0304
|
Empleando el mismo
procedimiento obtenemos la [Ca2+]:
|
VIAL
|
V AEDT
(mL)
|
[Ca2+]
(M)
|
|
Agua Destilada
|
12.55
|
0.0251
|
|
NaCl 0.05 M
|
13.1
|
0.0262
|
|
NaCl 0.1 M
|
13.9
|
0.0278
|
|
NaCl 0.2 M
|
14.4
|
0.0288
|
|
NaCl 0.4 M
|
15.7
|
0.0314
|
|
NaCl 0.6 M
|
16.0
|
0.032
|
|
NaOH 0.1 M
|
5.0
|
0.01
|
|
CaCl2 0.1
M
|
|
|
Para el octavo vial (en
el que añadimos CaCl2) recurrimos a una aproximación parecida:
Las solubilidades
reales, por tanto, han sido:
|
VIAL
|
[OH-]
(M)
|
[Ca2+]
(M)
|
Solubilidad Real (mol/L)
|
|
Agua Destilada
|
0.0366
|
0.0251
|
0.0251
|
|
NaCl 0.05 M
|
0.0412
|
0.0262
|
0.0223
|
|
NaCl 0.1 M
|
0.0416
|
0.0278
|
0.0229
|
|
NaCl 0.2 M
|
0.0458
|
0.0288
|
0.0247
|
|
NaCl 0.4 M
|
0.0482
|
0.0314
|
0.0263
|
|
NaCl 0.6 M
|
0.05
|
0.032
|
0.0271
|
|
NaOH 0.1 M
|
|
0.01
|
0.01
|
|
CaCl2 0.1
M
|
0.0304
|
|
0.0152
|
Podemos comparar estos
datos con la solubilidad teórica:
|
VIAL
|
Solubilidad Teórica (mol/L)
|
Solubilidad Real (mol/L)
|
Diferencia
|
|
Agua Destilada
|
0.0118
|
0.0251
|
52.99%
|
|
NaOH 0.1 M
|
6.5·10-4
|
0.01
|
93.5%
|
|
CaCl2
0.1 M
|
4.031·10-3
|
0.0152
|
73.48%
|
Lo cual demuestra que
la diferencia entre la Solubilidad Real y la Solubilidad Teórica sin tener en
cuenta la fuerza iónica son muy grandes. En conclusión, el efecto de la fuerza
iónica es demasiado grande como para no ser tenido en cuenta y debemos proceder
a calcular cómo influye en el proceso de disolución. El método que a
continuación emplearemos consiste en el cálculo iterativo, de manera que el
valor se recalcula varias veces hasta que finalmente se obtiene un valor
constante:
MUESTRA 1 – AGUA DESTILADA
|
μ
|
γ(OH-)
|
γ(Ca2+)
|
Solubilidad
|
|
0
|
1
|
1
|
0,011756673
|
|
0,035270019
|
0,83424373
|
0,52568876
|
0,016437897
|
|
0,049313691
|
0,81257696
|
0,4845494
|
0,017189455
|
|
0,051568364
|
0,80956245
|
0,4791057
|
0,017297119
|
|
0,051891357
|
0,80913918
|
0,47834662
|
0,017312299
|
|
0,051936896
|
0,80907967
|
0,47824
|
0,017314434
|
|
0,051943302
|
0,8090713
|
0,47822501
|
0,017314734
|
|
0,051944203
|
0,80907012
|
0,4782229
|
0,017314776
|
MUESTRA 2 – NaCl 0.05M
|
μ
|
γ(OH-)
|
γ(Ca2+)
|
Solubilidad
|
|
0
|
1
|
1
|
0,011756673
|
|
0,085270019
|
0,77381122
|
0,41931397
|
0,018635798
|
|
0,105907394
|
0,75747866
|
0,39469798
|
0,019287794
|
|
0,107863381
|
0,75607782
|
0,39265947
|
0,019344972
|
|
0,108034915
|
0,75595604
|
0,39248278
|
0,019349952
|
|
0,108049856
|
0,75594544
|
0,3924674
|
0,019350386
|
|
0,108051157
|
0,75594452
|
0,39246607
|
0,019350423
|
MUESTRA 3 – NaCl 0.1M
|
μ
|
γ(OH-)
|
γ(Ca2+)
|
Solubilidad
|
|
0
|
1
|
1
|
0,011756673
|
|
0,135270019
|
0,73850085
|
0,36800973
|
0,020080014
|
|
0,160240043
|
0,72509276
|
0,35030987
|
0,020663535
|
|
0,161990605
|
0,72422649
|
0,34919768
|
0,020701941
|
|
0,162105823
|
0,72416978
|
0,349125
|
0,020704458
|
|
0,162113375
|
0,72416606
|
0,34912024
|
0,020704623
|
MUESTRA 4 – NaCl 0.2M
|
μ
|
γ(OH-)
|
γ(Ca2+)
|
Solubilidad
|
|
0
|
1
|
1
|
0,011756673
|
|
0,235270019
|
0,69414527
|
0,31279276
|
0,022091844
|
|
0,266275533
|
0,68408005
|
0,301519
|
0,022582652
|
|
0,267747956
|
0,68363133
|
0,30102639
|
0,02260485
|
|
0,267814549
|
0,6836111
|
0,3010042
|
0,022605851
|
|
0,267817554
|
0,68361018
|
0,3010032
|
0,022605897
|
MUESTRA 5 – NaCl 0.4M
|
μ
|
γ(OH-)
|
γ(Ca2+)
|
Solubilidad
|
|
0
|
1
|
1
|
0,011756673
|
|
0,435270019
|
0,64422959
|
0,26087364
|
0,024666864
|
|
0,474000593
|
0,63739544
|
0,25449412
|
0,025048741
|
|
0,475146223
|
0,63720245
|
0,25431632
|
0,025059636
|
|
0,475178907
|
0,63719695
|
0,25431126
|
0,025059946
|
|
0,475179839
|
0,6371968
|
0,25431111
|
0,025059955
|
|
0,475179865
|
0,63719679
|
0,25431111
|
0,025059955
|
|
0,475179866
|
0,63719679
|
0,25431111
|
0,025059955
|
MUESTRA 6 – NaCl 0.6M
|
μ
|
γ(OH-)
|
γ(Ca2+)
|
Solubilidad
|
|
0
|
1
|
1
|
0,011756673
|
|
0,635270019
|
0,61425762
|
0,23406042
|
0,026400253
|
|
0,679200759
|
0,60906546
|
0,22971043
|
0,026716623
|
|
0,68014987
|
0,60895744
|
0,22962082
|
0,026723258
|
|
0,680169774
|
0,60895518
|
0,22961894
|
0,026723397
|
|
0,680170192
|
0,60895513
|
0,2296189
|
0,0267234
|
|
0,6801702
|
0,60895513
|
0,2296189
|
0,0267234
|
|
0,6801702
|
0,60895513
|
0,2296189
|
0,0267234
|
MUESTRA 7 – NaOH 0.1M
|
μ
|
γ(OH-)
|
γ(Ca2+)
|
Solubilidad
|
|
0
|
1
|
1
|
|
|
0.102
|
0,76038338
|
0,39896088
|
0,00281785
|
|
0.108
|
0,75565953
|
0,39205293
|
0,002903463
|
|
0.109
|
0,75547811
|
0,39179018
|
0,002906806
|
|
0.109
|
0,75547103
|
0,39177994
|
0,002906936
|
|
0.109
|
0,75547076
|
0,39177954
|
0,002906941
|
|
0.109
|
0,75547075
|
0,39177952
|
0,002906942
|
MUESTRA 8 – CaCl2 0.1M
|
μ
|
γ(OH-)
|
γ(Ca2+)
|
Solubilidad
|
|
0
|
1
|
1
|
0,004031129
|
|
0.312
|
0,67116031
|
0,28766612
|
0,011198402
|
|
0.334
|
0,66574441
|
0,28205764
|
0,011401191
|
|
0.334
|
0,6655964
|
0,28190597
|
0,011406794
|
|
0.334
|
0,66559231
|
0,28190179
|
0,011406948
|
|
0.334
|
0,6655922
|
0,28190167
|
0,011406952
|
|
0.334
|
0,6655922
|
0,28190167
|
0,011406953
|
|
0.3341
|
0,6655922
|
0,28190167
|
0,011406953
|
En resumen:
|
DISOLUCIÓN
|
μ
(mol/L)
|
SOLUBILIDAD
CALCULADA
(mol/L)
|
SOLUBILIDAD REAL
(mol/L)
|
DIFERENCIA
|
|
Agua Destilada
|
0,051944203
|
0,017314776
|
0.0251
|
31.02%
|
|
NaCl 0.05 M
|
0,108051157
|
0,019350423
|
0.0223
|
13.23%
|
|
NaCl 0.1 M
|
0,162113375
|
0,020704623
|
0.0229
|
9.59%
|
|
NaCl 0.2 M
|
0,267817554
|
0,022605897
|
0.0247
|
8.48%
|
|
NaCl 0.4 M
|
0,475179866
|
0,025059955
|
0.0263
|
4.72%
|
|
NaCl 0.6 M
|
0,6801702
|
0,0267234
|
0.0271
|
1.39%
|
|
NaOH 0.1 M
|
0,109
|
0,002906942
|
0.01
|
70.93%
|
|
CaCl2 0.1
M
|
0,3341
|
0,011406953
|
0.0152
|
24.95%
|
Ahora observamos que
las diferencias entre lo calculado y lo obtenido experimentalmente son más
pequeñas, ya que hemos tenido en cuenta la fuerza iónica. Algunos de estos
errores son muy pequeños, como el caso del NaCl 0.6M, donde apenas hay
diferencia entre los datos, sin embargo para el agua destilada sigue siendo
elevado, lo cual se explica porque tiene
una fuerza iónica muy baja y por tanto no puede explicarse la incertidumbre que
tenemos en la medida con esta hipótesis. El dato que mas discrepancia presenta
es el NaOH, debido a la presencia del ión común, razón que también se puede
aplicar al caso del CaCl2.
Sin embargo, es más que
apreciable que en general hay mucha menos diferencia si tenemos en cuenta las
fuerzas iónicas que si las obviamos.